Ci-dessus :
Première vidéo d’une série de sept, Quinze centimètres nage libre présente l’épigénétique de manière ludique et décalée.
Depuis près de 20 ans, les scientifiques scrutent de près un processus biologique que l’on appelle le « marquage épigénétique ». Pour faire simple, il s’agit d’une modification chimique de l’ADN qui a pour effet d’activer ou de désactiver l’expression de certains gènes. Il pourrait être induit par notre environnement et notre mode de vie. Cette nouvelle génétique est porteuse d’espoirs encore plus grands que le séquençage du génome, réalisé dans les années 2000, car elle apporterait les preuves que nous pouvons être maîtres de notre santé, en adoptant les comportements qui influencent directement l’expression de nos gènes. Bien se nourrir, bien dormir, pratiquer une activité physique, mais aussi rire, danser, écouter de la musique, méditer, nous permettrait d’agir au cœur même de nos cellules ! Tempérons notre enthousiasme, cela ne se fait pas d’un claquement de doigts, ni en mangeant un peu de brocoli. Mais, avec l’épigénétique, la science n’a peut-être jamais été aussi près d’une rupture définitive avec Descartes et sa distinction entre l’âme et le corps.
Petit rappel de nos cours de biologie
Sans entrer dans le détail, rappelons que nos chromosomes sont composés d’ADN, une molécule présente dans toutes les cellules vivantes et qui contient l’ensemble du génome, c’est-à-dire tous les gènes permettant aux êtres vivants de se construire, de vivre et de se reproduire. Identifié et isolé pour la première fois en 1869 par le Suisse Friedrich Miescher, l’ADN est resté mystérieux pendant longtemps et n’a commencé à être décrypté qu’au début des années 70.
Chaque gène est porteur d’une « information » dont la transcription, selon un processus chimique complexe, aboutit à la production des protéines qui composent notre organisme. Par exemple, le chromosome 15 possède deux gènes correspondant à la couleur des yeux. Concrètement, ils vont permettre la production de la protéine P en plus ou moins grande quantité, ce qui a un impact sur le type et la qualité d’un pigment biologique, la mélanine, qui donne sa couleur à l’iris. Evidemment, en réalité, les choses ne sont pas si simples et il faut souvent une combinaison de gènes pour « contrôler » le caractère final. Dans notre exemple, la couleur des yeux n’est pas seulement déterminée par deux gènes, mais au moins 150 selon un degré plus ou moins élevé.
Parmi nos gènes, certains ont muté et ne remplissent plus leur rôle, ce qui entraine des maladies. C’est, par exemple, le cas de l’hémophilie, due à la mutation d’un gène du chromosome X dont seuls les garçons sont porteurs, ou de certains cancers.
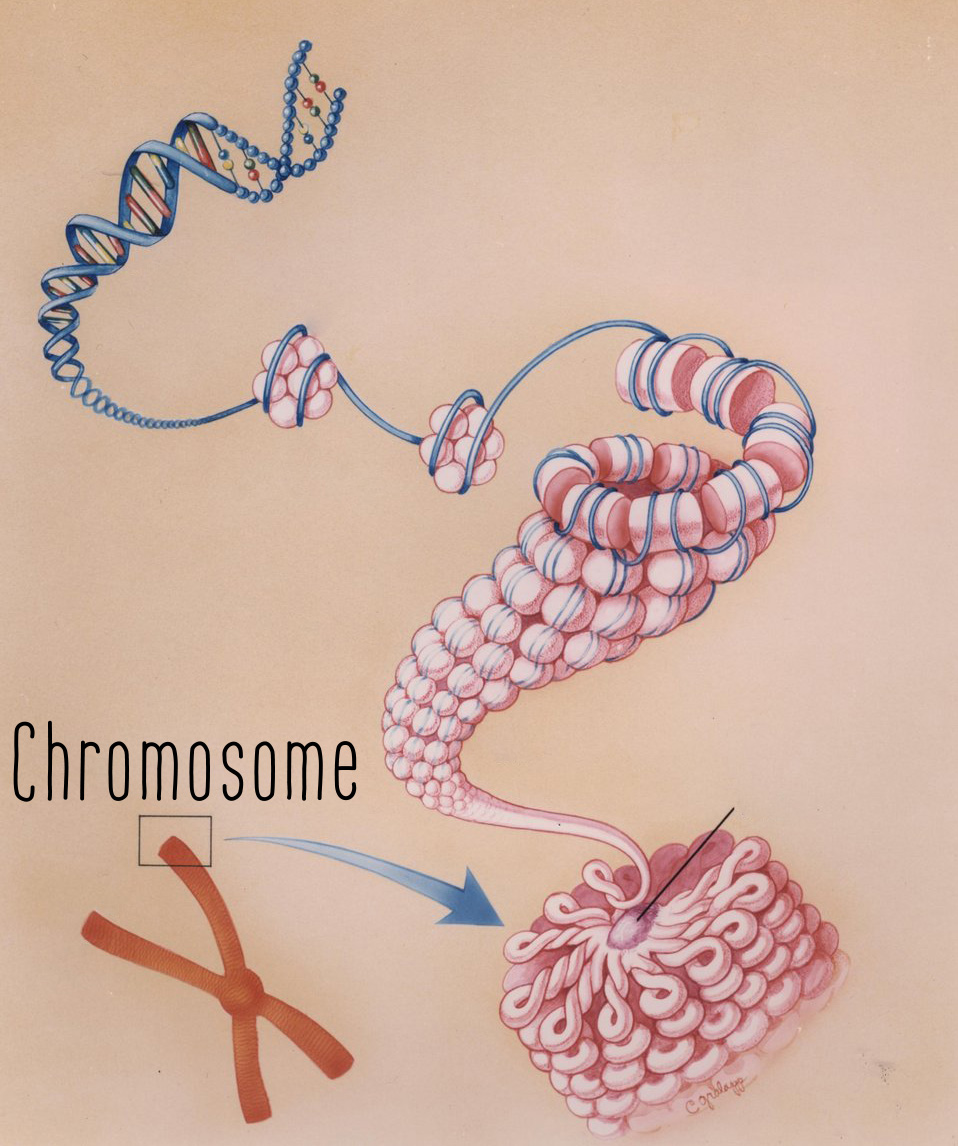 Structure du chromosome – © US Department of Energy
Structure du chromosome – © US Department of EnergyL’ADN et ses surprises
En 1990 fut lancé le Projet Génome Humain pour établir le séquençage complet de l’ADN humain, c’est-à-dire la lecture intégrale de la succession des gènes de chaque chromosome (nous en comptons 23 paires). Achevé le 14 avril 2003, ce séquençage permet de prévenir certaines maladies génétiques ou prédispositions à des maladies. On sait, par exemple, apporter un gène normal et fonctionnel dans une cellule où le gène présent est altéré, comme dans la thérapie génique contre des déficits immunitaires chez les bébé-bulles. Le séquençage permet aussi une opération préventive, comme une masectomie des seins en prévention d’un cancer, pour les femmes porteuses d’une mutation génétique prédisposant à cette maladie sur le gène BRCA1, BRCA2 ou PALB2.
Cependant, le séquençage apporta quelques surprises. On se rendit compte que les gènes n’étaient pas répartis uniformément sur le génome, et qu’il existait des zones qui n’en contenaient aucun : 98 % de l’ADN n’était pas utilisé pour synthétiser des protéines. Les biologistes conclurent que « la majeure partie de l’ADN était une sorte de poubelle dans laquelle se seraient accumulés tous les gènes inutiles, répliqués ou dépassés » (The Good Life 2018). Conclusion hâtive, car évidemment il n’en est rien.
Dans le prolongement d’études sur la régulation des gènes menées depuis les années 60, on fit retomber les gènes du piédestal où la génétique les avait placés, pour s’intéresser à l’écosystème cellulaire complexe qui les entoure et qui permet leur expression. Dans cette nouvelle manière de penser la génétique, les gènes poubelle sont beaucoup plus utiles qu’on ne le pensait, et « la manière dont les gènes sont lus est sans doute bien plus importante que le code génétique lui-même » (RTFlash 2016).
L’ADN n’est qu’un élément de notre identité génétique
Quand on a découvert l’ADN, raconte le biologiste Edith Heard, « on a constaté, avec une certaine incrédulité au début, que toutes les cellules de notre corps avaient le même ADN que dans l’œuf fécondé. Rien à voir pourtant entre une cellule du foie, de muscle ou un neurone, par exemple. Puisque l’intégralité du code ADN est conservée dans les cellules, la question des scientifiques est donc devenue : comment les cellules acquièrent-elles leur identité propre, et comment celle-ci se maintient-elle au cours des divisions cellulaires ? ».
La réponse ? Des modifications chimiques de l’ADN, c’est-à-dire un marquage épigénétique, permettent aux cellules de notre corps de se différencier au cours du développement embryonnaire. Cette régulation de l’expression de nos gènes, dans la même séquence ADN d’origine, permet de l’interpréter différemment grâce à des processus chimiques qui viennent activer et désactiver certains gènes.
Née dans les années 50, la notion d’épigénétique expliquait comment la synthèse d’une protéine, à partir du système génétique, était contrôlée par un sytème qui assurait la production de cette protéine en bonne quantité, au bon moment et dans les bons tissus. Mais ce n’est qu’à partir des années 90 que l’on commence à mieux comprendre ce système et que l’on introduit la notion de « marque épigénétique » (Michel Morange 2014).
Une nouvelle vision de l’ADN se construit alors. Longtemps considéré comme un « livre de la vie » dictant notre développement et notre fonctionnement biologique, comme une structure déterminant le devenir des organismes, on le conçoit aujourd’hui comme une ressource mise à la disposition de ces organismes (Henri Atlan, 1990). On pense même que la différenciation cellulaire ne répondrait pas à un supposé code inscrit dans ses gènes, mais s’effectuerait selon un processus aléatoire dans lequel les interactions avec l’ensemble de l’organisme et l’environment sont essentiels. Pour le biologiste Olivier Gandrillon, « l’information première n’est pas dans le génome, mais dans l’environnement […], le génome n’est plus le pilote ni la fondation de la cellule, mais un élément parmi d’autres. Gènes, cytoplasmes, mitochondries, métabolisme, milieu extérieur… tout s’influence ».
Les études se multiplient
Si les mécanismes par lesquels l’environnement influencent le génome ne sont pas encore entièrement élucidés, on sait aujourd’hui que les facteurs épigénétiques expliquent en partie l’apparition ou le renforcement de maladies, comme le cancer du sein évoqué plus haut.
Pour une femme porteuse d’un gène BRCA1 muté, le risque d’avoir un cancer du sein avant 70 ans est de 50 à 80 %, contre 10 à 12 % pour les autres femmes. Le gène BRCA1 est un gène « gardiens du génome » dont la mutation héréditaire a pour conséquence de rendre plus probable l’activation d’un processus de cancérogenèse (Odile Cohen-Haguenauer 2019). Mais des chercheurs se sont aperçus que, même en l’absence de mutation, une femme atteinte d’un cancer pouvait présenter une anomalie du gène BRCA1 prenant la forme d’une diminution de l’activité du gène BRCA1. Cette anomalie est épigénétique et provoque les même effets, c’est-à-dire la transformation de cellules saines en cellules cancéreuses (article au format PDF).
Or, selon une thèse récente, l’activité du gène BRCA1 dans la glande mammaire pourrait être modulée par un facteur alimentaire, comme la consommation de soja par exemple. De fait, le risque de développer un cancer du sein est bien moindre en Asie, où la consommation de soja est fréquente. L’alimentation de type méditerranéenne pourrait aussi avoir une action favorable sur l’expression du gène BRCA-1, tout comme l’activité physique (Remy Bosviel 2011).
D’autres facteurs influençant le marquage épigénétique peuvent être comportementaux. La comparaison entre les ADN d’enfants ayant été câlinés et ceux d’enfants ayant bénéficié de moins de contacts physiques lorsqu’ils étaient bébés, montre des différences épigénétiques, cinq ans plus tard, sur un gène du métabolisme et un autre du système immunitaire. Les câlins laissent des traces sur l’activité du génome ! Une autre étude montre un lien physiologique entre des abus sexuels subis pendant l’enfance, sources d’un stress intense, et le développement d’un trouble de la personnalité de type borderline à l’âge adulte. Ces actions violentes provoquent le marquage épigénétique d’un gène (NR3C1), ce qui entraine une production réduite de la protéine chargée d’inhiber une hormone du stress. Cette modification se maintient jusqu’à l’âge adulte, où le moindre stress peut entraîner une réaction excessive en raison de la dérégulation de cette hormone (Nader Perroud 2012).
Intéressons-nous au sommeil, indispensable pour réparer les effets du stress de la journée. Les études montrent que le sommeil est essentiel dans le maintien de l’intégrité de nos chromosomes. Les médecins travaillant de nuit, privés de sommeil, présentent des « fissures » au niveau des brins d’ADN. Après plusieurs nuits passées sans dormir, l’ADN n’a pas le temps de se reconstituer et les fissures s’accumulent (V. Cheung V., M. Yuen, G. T. C. Wong, S. W. Choi 2019).
Vous l’aurez compris, si le stress, le sommeil ou l’alimentation influencent le génome dans un sens, sans toucher aux gènes mais simplement en leur associant un marquage chimique, ils peuvent aussi l’influencer dans l’autre sens. Un sommeil de qualité, une gestion du stress efficace, une alimentation adaptée, permettent de réguler l’expression des gènes, de maintenir l’efficacité de ceux qui sont utiles, et de contrer l’expression de ceux qui sont mauvais pour notre santé.
Le dernier exemple est tiré d’une série d’études faites auprès de mères célibataires qui élèvent des enfants souffrant de handicap. Chez elles, les chromosomes sont altérés, leurs terminaisons, appelées télomères, sont beaucoup plus courtes que dans un groupe témoin (Epel 2004). Mais ce qu’il faut retenir ici, c’est qu’en participant à un groupe de soutien dans lequel elles peuvent parler, partager leur expérience, faire part de leurs difficultés, ces femmes réparent leurs chromosomes.
Les modifications épigénétiques sont réversibles, et elles peuvent être provoquées par l’environnement. Stress, sédentarité, mal-bouffe, exposition à des toxiques multiples et variés, impactent directement notre physiologie et le fonctionnement-même de nos gènes. Heureusement, nous ne sommes pas condamnés à vivre stressés, ni à surconsommer de la graisse et du sucre, à fumer ou à rester assis.
En adoptant un mode de vie sain, nous aidons nos cellules à allumer les bons gènes et à mettre les mauvais en veilleuse. On essaie ?
POUR ALLER PLUS LOIN
• Je vous conseille la lecture des articles passionnants édités par l’Encyclopédie de l’environnement, et pour commencer Epigénétique : Comment l’environnement influence nos gènes.

• Bien qu’un peu ancien (il a cinq ans !), le dossier que l’INSERM consacre à l’épigénétique est synthétique et clair : « Epigénétique. Un génome, plein de possibilité ! ».
Crédits
Vidéo : © Ethnomedia / jcm pour Apivia Prévention