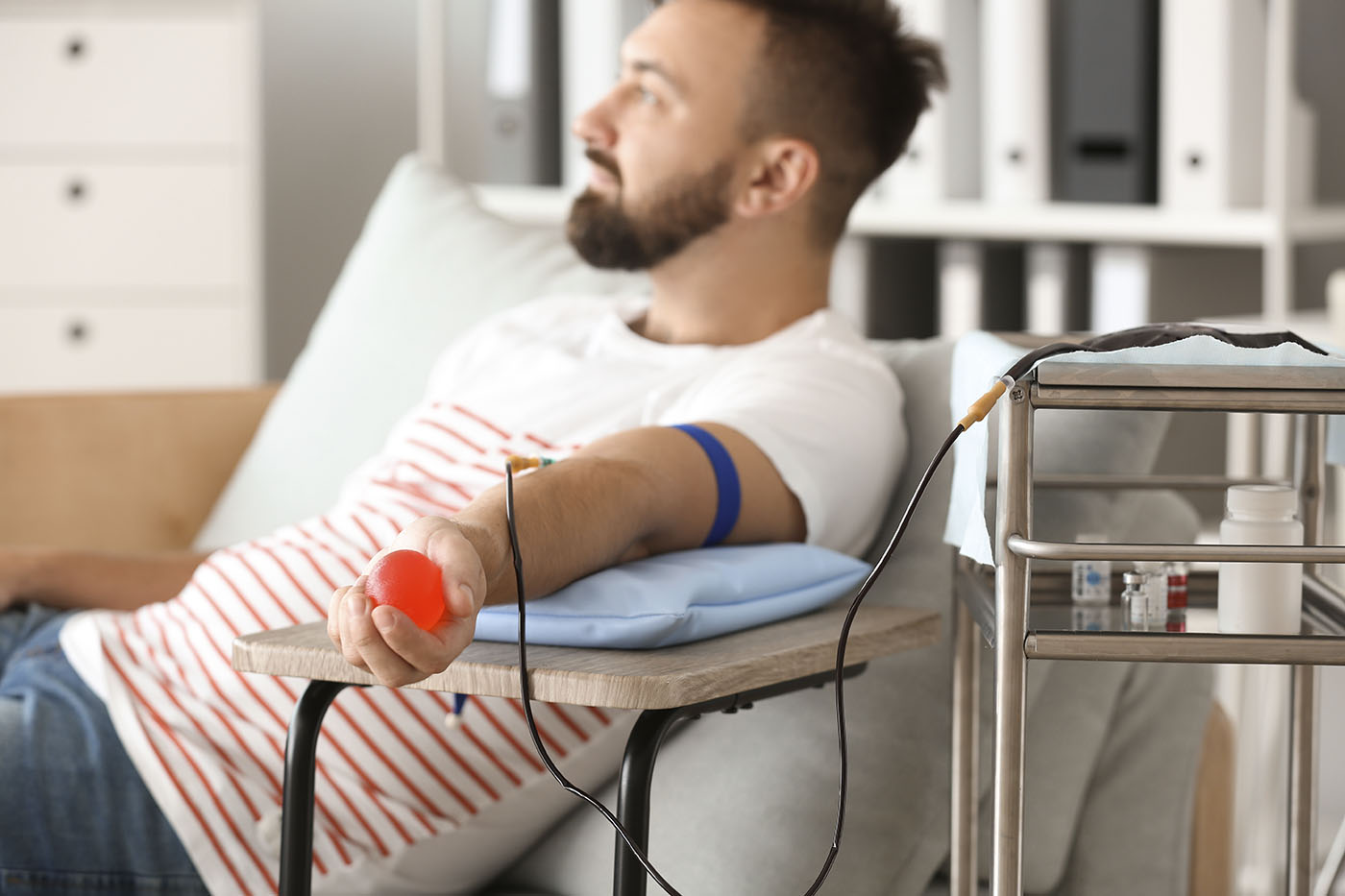
L’hémochromatose est une maladie génétique fréquente entraînant un taux de fer toxique pour l’organisme. Potentiellement grave après la quarantaine, ses symptômes sont difficiles à interpréter, mais son diagnostic est enfantin et se fait grâce à une banale prise de sang. Son traitement est, par ailleurs, relativement simple et efficace : la saignée. A quand un dépistage systématique avant les complications ?
A consulter :
Notre interview du Dr Dominique Lannes sur l’hémochromatose, dont il est lui même atteint.
C’est le médecin tourangeau Armand Trousseau qui, en 1865, décrit pour la première fois un patient atteint de diabète, bronzé de peau et au foie dur. Il était atteint d’hémochromatose. Le diagnostic clinique de cette maladie est impossible à faire chez le sujet jeune qui ne se plaint de rien, et il est ensuite très difficile tellement les signes ne sont… évocateurs de rien du tout pour le médecin. Qui n’a pas été fatigué dans sa vie ? Qui n’a pas eu de douleurs articulaires ? Dans 85 % des cas, le diagnostic est tardif, en moyenne une dizaine d’années après l’apparition des premiers symptômes. En France, des milliers de personnes sont en souffrance sans savoir qu’ils sont atteints d’hémochromatose et que leur corps est intoxiqué au fer.
Le FER c’est de l’OR dans notre organisme !
Le fer est vital, au cœur des réactions chimiques qui ont lieu dans nos cellules. Il participe ainsi au fonctionnement des enzymes et joue un rôle primordial dans les réactions d’oxydoréduction. En d’autres termes, dans la respiration de chaque cellule de notre organisme. Il se retrouve donc impliqué dans une foule de fonctions physiologiques, comme la synthèse des protéines, des neurotransmetteurs, de l’ADN ou encore la régulation des lipides et le métabolisme musculaire. Mais, c’est par sa capacité à fixer l’oxygène sur une protéine des globules rouges (l’hémoglobine), que le fer montre de façon éclatante son caractère indispensable à la vie. Grâce au fer, l’hémoglobine assure le transport sanguin puis la distribution de l’oxygène à tous les organes. Le fer fixe l’oxygène dans les poumons puis le largue, jusqu’à nos doigts de pied… Ainsi, ce métal précieux par excellence, amoureux avide d’oxygène, nous permet tout simplement de vivre et bouger !
Le chemin du FER
A l’état normal, notre stock en fer est de 3 à 5 g, l’équivalent d’un clou, mais ce n’est pas assez pour faire sonner un détecteur de métal à l’aéroport !
C’est notre alimentation qui entretient ce stock. Par exemple, un bon steak saignant ou du boudin noir sont riches en résidus de globules rouges, donc riches en fer. Mais, en réalité, tout ce que nous mangeons contient du fer en quantité plus ou moins importante. Absorbé par la partie haute de l’intestin, juste après l’estomac, il traverse les cellules intestinales puis passe dans le sang, avant d’être véhiculé par un transporteur appelé la transferrine, partout où c’est nécessaire et, en particulier, dans la moëlle osseuse, site de fabrication des globules rouges. Notre alimentation nous apporte quotidiennement 10 à 20 mg de fer, mais seulement 1 à 2 mg passent dans le sang. Notre foie fabrique en effet un frein puissant à l’absorption du fer, une hormone agissant directement sur les cellules intestinales : l’hepcidine.
Cependant, le fer est si précieux à la vie que la nature veut toujours le garder comme un trésor et n’a rien prévu pour l’éliminer, même en cas d’excès … Chez les femmes, le fer s’échappe avec le sang des menstruations, ce qui est une cause fréquente de carence en fer. Mais chez l’homme, le fer s’accumule au fil de sa vie.
Hémoglobine : protéine de transport de l’oxygène dans le sang. Une molécule d’hémoglobine contient 4 atomes de fer qui peut se lier de façon réversible à 1 atome d’oxygène, donc 4 atomes d’oxygène au maximum)
Ferritine : principale protéine de stockage du fer. La molécule de ferritine est une protéine intracellulaire pouvant contenir jusqu’à 4 000 à 4 500 atomes de fer. Dans le corps, de petites quantités de ferritine sont sécrétées dans la circulation sanguine. En l’absence d’inflammation, la concentration sanguine de cette ferritine est corrélée positivement avec la taille des réserves totales de fer corporel.
Transferrine (ou sidérophilline) : principale protéine de transport du fer dans le plasma. Elle peut fixer 2 atomes de fer par molécule
Comment une santé de FER peut vous conduire en enFER ?
Lorsque qu’on est atteint d’hémochromatose, la fameuse hormone hepcidine vient à manquer, les freins sont lâchés et le fer va très lentement et insidieusement, au fil des repas, des jours et des années, envahir, imprégner, inonder puis intoxiquer tout le corps. Les 30 à 35 premières années se passent bien, voire même très bien : les femmes, en dépit de pertes abondantes de sang par leurs règles, n’ont aucune anémie ; les hommes sont en pleine santé… à l’image de Popeye, marin de dessin animé, bourru, faisant étalage de sa force et de sa résistance physique grâce au fer frénétiquement ingéré sous forme d’épinards qui, soit dit en passant, ne sont pas particulièrement riches en fer… Cette santé de fer a probablement été un atout dans le passé lors des famines et des disettes.
Jour après jour, le capital fer de l’organisme augmente et va, au fil des années, plus ou moins rapidement, dépasser le cap des 3-4 g réglementaires… jusqu’à des niveaux pouvant friser les 30 g et plus ! La malédiction du fer se met alors en route. Après 30 à 35 ans, et surtout après la cinquantaine, les ennuis commencent, le fer en excès se dépose dans le corps et passe à l’action ! Lorsqu’il s’accumule dans un organe, il l’agresse et l’endommage à petit feu. Les scientifiques vous parleront de stress oxydatif, de radicaux libres produits par le fer en excès dans nos cellules, nous évoqueront plus simplement l’image de la rouille sur une carcasse métallique !
Les organes de prédilection pour les dépôts de fer sont en premier lieu le foie, les articulations, le pancréas, le coeur, les glandes endocrines et la peau. Mais finalement, c’est tout l’organisme qui est concerné par la surcharge et qui va pour ainsi dire rouiller, lentement mais sûrement, provoquant l’apparition d’un cortège de maux inexpliqués. Ainsi, au fil des années, apparaissent des symptômes banals, perfides, trompeurs car peu spécifiques et, surtout, très variables d’un malade à l’autre : une fatigue physique et psychique anormale, des douleurs diffuses, des problèmes articulaires attribués à tort à de l’arthrose, des troubles sexuels, un teint bronzé… Plus tardivement, un diabète et des problèmes cardiaques sérieux peuvent se déclarer. Quant au foie, qui attire le fer comme un aimant, il va lentement s’enflammer, se fibroser jusqu’au stade de cirrhose, favorisant par là-même l’apparition d’un nodule cancéreux.
Pourquoi l’hormone régulatrice du fer, l’hepcidine, vient-elle à manquer chez certaines personnes ? La réponse se trouve dans nos gènes : la fabrication de l’hepcidine par le foie est sous contrôle génétique. Une mutation au nom de code « C282Y » du gène HFE situé sur le chromosome 6 de notre ADN, est présente en double exemplaire chez les porteurs de la maladie (ce qu’on appelle une mutation homozygote). L’hémochromatose ne s’attrape donc pas mais se transmet par héritage de la mutation, et du père et de la mère. Ce sont les « noces de fer ».
La mutation C282Y nous vient d’Europe du Nord, elle s’est installée au gré des invasions, des guerres, des migrations des populations celtes, puis vikings, dans toute la France avec une densité maximale en Bretagne. Pour parler chiffres, une personne sur 300 en France est « homozygote C282Y ». En Bretagne, c’est une sur 200. L’hémochromatose C282Y est bien une maladie génétique à part entière, la plus fréquente en Occident … et l’on n’en parle jamais ! La mutation C282Y ne touche ni les africains ni les asiatiques.
Le statut homozygote C282Y, pour des raisons encore mal comprises, ne conduit pas inexorablement à l’hémochromatose, d’autres facteurs génétiques ou environnementaux restent à découvrir. Les femmes homozygotes C282Y sont atteintes, en règle générale, plus tardivement, surtout après la ménopause.
Le statut hétérozygote C282Y, c’est à dire avec la mutation en exemplaire unique dans notre patrimoine génétique, ne conduit pas à l’hémochromatose. Mais attention ! La mutation peut se transmettre aux enfants…
Il existe d’autres mutations du gène HFE beaucoup plus rares mais qui peuvent, à des degrés moindres, entraîner une surcharge en fer. Il vous reste à imaginer que toutes ces mutations, au gré des unions père-mère, peuvent se mélanger et vous comprendrez qu’il y a de quoi écrire un roman !
Le diagnostic de l’hémochromatose est facile : une simple prise de sang
Le diagnostic d’hémochromatose est d’une simplicité enfantine … si le médecin y pense ! Tout le problème est là.
Première étape : une simple prise de sang faite à jeun pour doser 2 paramètres cruciaux.
– Le taux de ferritine, protéine de stockage du fer. Il peut atteindre 10 fois la normale, et plus, chez le patient hémochromatosique.
– Le coefficient de saturation de la transferrine, le transporteur de fer dans le sang. Ce coefficient alerte, même chez les jeunes qui n’ont pas encore de surcharge en fer, et peuvent donc avoir des taux de ferritine encore normaux.
Une ferritine élevée et un coefficient de saturation de la transferrine supérieur à 45% doivent conduire le médecin à évoquer l’hémochromatose.
Seconde étape : confirmer le diagnostic par le recherche de la mutation génétique C282Y. Là encore, une simple prise de sang suffit, avec les précautions d’usage pour tout test génétique : le médecin doit donner une information claire et adaptée à la personne avant le prélèvement et celle-ci doit signer une notice d’information et de consentement.
Le résultat tombe : C282Y homozygote. Le diagnostic d’hémochromatose est fait, le traitement va pouvoir commencer.
Le traitement de l’hémochromatose : une bonne saignée !
Il n’existe pas encore de médicament ou, pour les amateurs de science fiction, de manipulation génétique permettant de guérir définitivement de l’hémochromatose. Compter sur un régime alimentaire « pauvre en fer » est par ailleurs illusoire. Il est important de bien manger et d’y trouver du plaisir. La solution radicale serait de remplacer le foie qui rechigne à fabriquer l’hepcidine par un autre plus vaillant . Cela se fait par transplantation hépatique en cas de cirrhose au bout du rouleau ou de nodule cancéreux… C’est lourd et compliqué. Pour éviter la rouille généralisée, la seule solution va donc être de débarrasser l’organisme de tout le fer en excès, puis d’éviter que la surcharge ne se reconstitue à bas bruit. Il y a beaucoup de fer dans le sang ?… Alors débarrassons-nous du sang et nous nous débarrassons du fer ! Comment ?… Par une bonne saignée, technique prisée des médecins du XVIème et XVIIème siècles qui, finalement, soignaient les hémochromatosiques sans le savoir – et envoyaient, en échange, de vie à trépas pas mal d’autres malades… En retirant de la circulation sanguine des globules rouges, riches en fer, on contraint l’organisme à puiser dans ses réserve « ferriques » pour en fabriquer de nouveaux.
Au départ, une saignée par semaine est généralement nécessaire, durant laquelle on prélève de 300 à 500 ml de sang selon le poids et le sexe. Ce « traitement d’attaque » supprime 200 mg de fer à chaque fois. Fait par une infirmière, il est efficace mais long : selon la quantité de fer à éliminer, il peut durer 1 à 2 ans, voire plus ! Les veines du bras sont très sollicitées, les globules rouges peuvent ne pas se reconstituer assez vite, obligeant à interrompre les saignées. Des malaises, une fatigue sont possibles… Bref, ces saignées itératives sont diversement bien supportées et ne sont pas une partie de plaisir ! Mais quelle satisfaction lorsque le radiologue vous montre une IRM de votre foie, qui est passé de la couleur noir charbon, signe de surcharge massive en fer, à un gris clair, signe d’un retour à la normale ! Les saignées ne sont alors pratiquées que tous les 2, 3 ou 4 mois, mais à vie. C’est le « traitement d’entretien ».
Instaurées avant l’âge de 30 ou 35 ans, c’est à dire avant que le fer ait fait ses dégâts sur l’organisme, les saignées peuvent améliorer rapidement la fatigue et permettent d’éviter les complications graves : atteinte du foie et du cœur, diabète… Ensuite, il n’est jamais trop tard pour agir, mais les saignées ne pourront qu’arrêter les dégâts sans retour à un corps neuf. Une fois l’organe lésé, aucune marche arrière n’est possible. Ni le coeur, ni le foie, ni le pancréas ne se « réparent », les dégâts sont irréversibles. La fatigue peut persister, la cirrhose, le diabète, les atteintes cardiaques se sont installés et ne veulent pas partir. Quant aux problèmes articulaires, ils vont bien souvent continuer à évoluer. On voit bien que pour intervenir tôt, il faut aussi diagnostiquer tôt. Or, pour cette maladie aux symptômes peu évocateurs, seul un dépistage massif de la population pourrait permettre un diagnostique précoce.
Si se soigner pouvait se transformer en acte de générosité ? Les malades atteints d’hémochromatose ont réussi ce petit miracle. Ils peuvent réaliser leur saignée dans le cadre du don du sang en respectant les mêmes restrictions que n’importe quel autre donneur de sang.
Quand enlever près d’un demi litre de sang régulièrement est irréalisable (en cas d’anémie, d’un réseau veineux abimé, de problèmes cardiovasculaires, etc.), on peut administrer des médicaments capables d’éliminer le fer. C’est assez exceptionnel car ces traitements ont des contraintes importantes.
Mieux vaut prévenir plutôt qu’aller en enFer : le dépistage
Bien que toutes les cases en faveur d’un dépistage généralisé soient au vert, bien qu’il y ait un enjeu de santé publique, aucun pays n’a franchi le pas et n’a proposé que la population-cible soit, au moins une fois dans sa vie, dépistée pour l’hémochromatose. Des milliers de malades sont en souffrance : fatigue, douleurs, dépression, diabète, cirrhose, troubles cardiaques. D’autres vont mourir prématurément de cirrhose, de cancer du foie, de diabète ou d’un problème cardiaque parce que il n’y a pas de dépistage généralisé dans la population. Certains malades et médecins parlent même de scandale de santé public.
La Haute Autorité de Santé jugeait, en 2004, l’option d’un dépistage massif de la mutation C282Y trop coûteuse et trop difficile à mettre en œuvre (lire le rapport au format PDF). En attendant des jours meilleurs, le diagnostic et la prévention des complications de l’hémochromatose repose sur les épaules des médecins de famille et de toutes les autres spécialités. Le médecin de famille doit demander de façon systématique dans le bilan de santé de ses patients, au moins une fois, le dosage de la ferritine et du coefficient de saturation de la transferrine. Bien sûr, cette demande est particulièrement importante à faire avant 40 ans, avant l’apparition des complications. Le rhumatologue, le cardiologue, l’Hépatogastroentérologue, l’endocrinologue, le psychiatre, etc., doivent avoir la « ferritine facile », quels que soient les motifs de consultation des patients. L’hémochromatose est un véritable caméléon qui se cache derrière chaque trouble, même les plus banals !
Lorsqu’un patient vient d’être diagnostiqué hémochromatose génétique, son médecin doit bien l’informer que toute la famille doit passer au dépistage, frères et soeurs, parents, enfants majeurs… C’est l’occasion de retisser des liens familiaux et de faire son arbre généalogique, et il peut y avoir des surprises : un père cirrhotique alors qu’il ne buvait pas d’alcool, une sœur diabétique et perclue « d’arthrose »…
Si l’hémochromatose était dépistée avant 30 ans, la maladie n’existerait plus et, cerise sur le gâteau, cela ferait des heureux : les centres du don du sang recevraient des centaines de milliers de clients fidèles et motivés !
Santé fiction
Tout français a une prise de sang au moins une fois dans sa vie, ça c’est la réalité. Grâce aux puissants moyens d’interconnexion des laboratoires de biologie, à l’intelligence artificielle, aux algorithmes, bref, à toute la haute technologie permettant qu’un ordinateur bienveillant s’assure que la ferritine et le coefficient de saturation de la transferrine soient dosés une fois dans la vie pour tout le monde, toute personne est dépistée très tôt. Les homozygotes C282Y vont régulièrement donner leur sang et ceux qui ne supportent pas la vue du sang, qui ont des veines fragiles, ont à disposition un traitement simple à base d’Hepcidine de synthèse. L’hémochromatose est à ranger dans les vieux livres de médecine au chapitre « maladie disparue ». Les hémochromatosiques vieillissent plus longtemps et en bonne santé !
POUR ALLER PLUS LOIN
• Fédération Française des Associations de Malades de l’Hémochromatose – 60 rue du Rendez-vous – 75012 Paris – www.hemochromatose.org
• Association Hémochromatose France – 13 rue Maurice Monti – Parc de Magaille – 30000 Nîmes – www.hemochromatose.fr
Crédits
Photo : © Adobe Stock